概要
弱酸(もしくは弱塩基)とその塩の混合水溶液には、酸や塩基の水溶液を少し加えても、 の値をほぼ一定に保つはたらきがある。�このはたらきを緩衝作用といい、このような水溶液を緩衝液(緩衝溶液) という。
詳細
では、具体例を通じて、緩衝作用の背景をしっかりと理解しよう!背景が分かればたいしたことはない。
ここでは、酢酸 と酢酸ナトリウム を混ぜた水溶液を考える。
酢酸 は弱酸、酢酸ナトリウム は弱酸によってできた塩であることに注目。
この水溶液中では、以下の反応が起こっている。
このとき、塩である酢酸ナトリウム はほぼ完全に電離するが、酢酸 は弱酸であり、 のような電離平衡が成り立つ点に注意!
ちなみに、 によって水溶液中に がたくさん供給されるので、緩衝溶液中では の電離平衡はかなり左に偏っており、酢酸はほとんど電離していない状態となる。
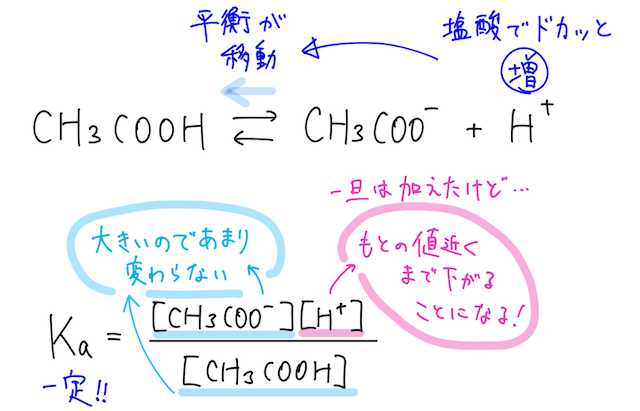
酸を加えると...
ここに、少量の塩酸を加えると、水溶液中の水素イオン が増えるので、 の電離平衡は左に移動する。
緩衝液には、酢酸ナトリウム を混ぜていることによって がたくさん存在しているので、 の電離平衡での の濃度は、平衡が左に移動してもそこまで大きくは変わらない。
そのため、電離定数の式を考えれば、水素イオン は元の値に近い濃度になるまで減っていくことになるので、水溶液の はほぼ変化しない。
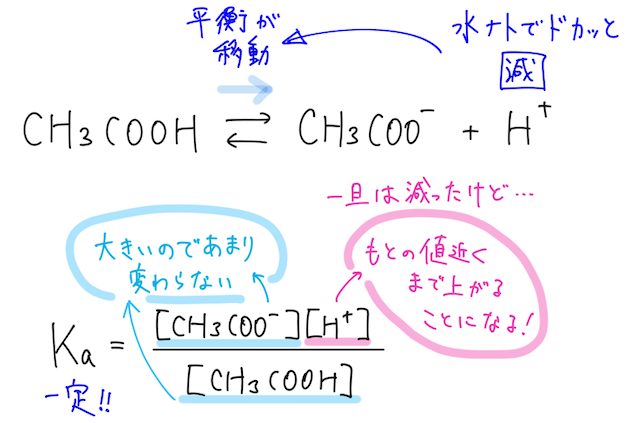
塩基を加えると...
一方で、少量の水酸化ナトリウム水溶液を加えると、水溶液中の水酸化物イオン が増え、水溶液中の水素イオン と反応して水になるので、水素イオン は減る。
その結果、 の電離平衡は右に移動する。
緩衝液には、酢酸ナトリウム を混ぜていることによって がたくさん存在しているので、 の電離平衡での の濃度は、平衡が右に移動してもそこまで大きくは変わらない。
そのため、水素イオン は元の値に近い濃度になるまで補給されることになり、せっかく加えた水酸化物イオン はどんどん減っていくので、水溶液の はほぼ変化しない。
このように、酢酸 と酢酸ナトリウム を混ぜた水溶液には、酸や塩基の水溶液を少し加えても、 の値をほぼ一定に保つはたらきがあることがわかる!






