ヘンリーの法則
概要
「ヘンリーの法則」とは、気体の粒は圧力に比例して液体に溶解するという法則のこと。もっと雑に言えば「押せば押すほど溶ける法則」です。
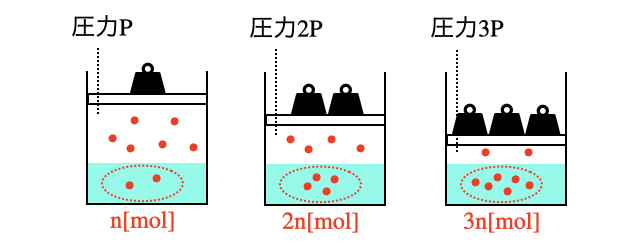
ただし、気体の体積は圧力と温度によって変化するため、溶けた気体を体積で数える場合は注意が必要です。
詳細
物質量で数える場合
ヘンリーの法則は、物質量で考える場合は超絶簡単な法則です。たとえば1気圧で10粒溶けるなら、2気圧で20粒、3気圧で30粒溶けるというだけです。

例題も見てみましょう。

圧力が5倍になればヘンリーの法則より5倍の物質量が溶け、1Lの水が2Lに増えれば当然2倍溶けます。よって溶ける物質量は、
溶けるモルがわかったので、これに分子量を掛け算すれば、
体積で数える場合
しかし体積で数える場合は注意が必要です。気体の体積は温度と圧力によって変化するため、どの条件で体積を数えるかが重要です。まずは溶けた気体の体積を数えるために、溶液中の気体分子を風船に閉じ込めてみましょう。
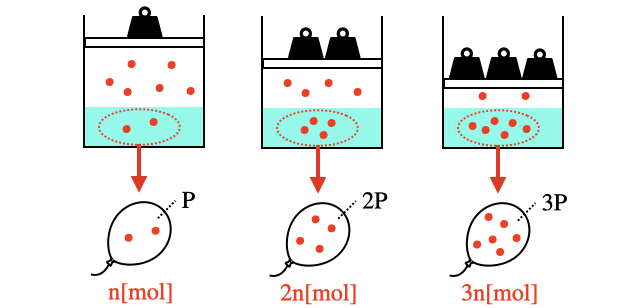
これら溶けた気体の体積は、以下のように、1気圧なら1気圧、2気圧なら2気圧と圧力下で数えればどんな場合でも溶ける気体の体積は一定になります。
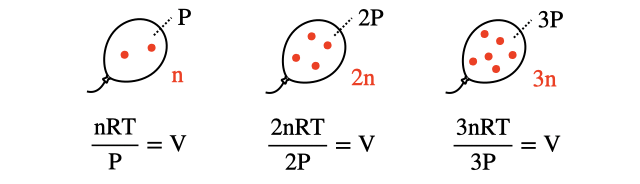
「さっき押すほど溶けるって言ったじゃないか!一定とは何事だ!」なんていう人はいませんよね。粒の数は2倍・3倍と増えるけど圧力も2倍・3倍と増えているので、結局体積は圧縮されていつでも一定になるということです。逆に、体積を常に基準の圧力で数えれば溶ける体積は気体の圧力に比例します。
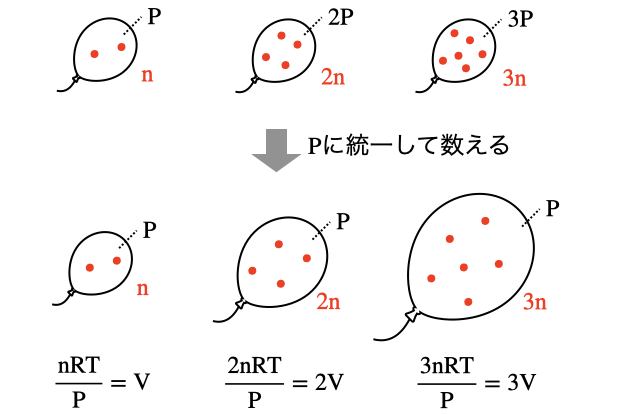
どの圧力でカウントしているかが重要です。
気体の溶解度
気体の溶解度は、「ある温度で1L(1mL)の水に溶ける気体の量(mol,L,mL)」 で与えられます。問題によって水や気体を数える単位が違うことに注意しましょう。
ただし気体を体積で数えるとき、どの圧力・温度で数えるかが重要でしたね。気体の溶解度では、溶けた気体の体積を標準状態に換算したものが与えられます。つまりLで与えられたときは22.4L/molで、mLで与えられたときは22400mL/molで割り算すればmolに直ります。原則、mLやLで与えられてもmolで考えるのが楽です。

体積[L]では圧力・温度で変化してしまうのでモルに直して考えましょう。標準状態で0.016Lなので、
あとは先ほどと同じです。圧力が5倍になればヘンリーの法則より5倍の物質量が溶け、1Lの水が10Lに増えれば当然10倍溶けます。よって溶ける物質量は、
溶けるモルがわかったので、これに分子量を掛け算すれば、
補足
- 化学好きな投稿大生かずきさん・ただよびベーシック理系さん・受験メモ山本・予備校のノリで学ぶ大学の数学物理さんなどの動画もチェック!
関連動画
関連用語




