質量数
概要
「質量数」とは、原子核に含まれる陽子の数と中性子の数の合計こと。原子は陽子・中性子・電子からなりますが、原子の質量はほぼ陽子と中性子で決まるのでこのように呼ばれます。
記号で書くときは元素記号の左上に書きます。
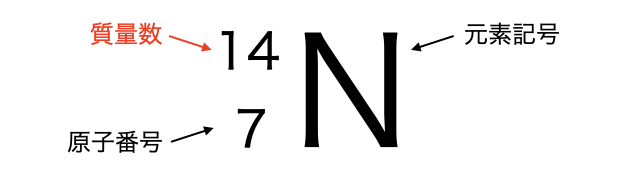
ちなみに左下の数字を「原子番号」といい、陽子の数を表します。
詳細
質量数の意味
原子の種類は、陽子の数と中性子の数で決まります。 陽子の数は原子番号からわかり、中性子の数は質量数から陽子の数を引き算すればわかりますので、原子番号と質量数がわかれば原子を特定できます。

「それなら最初から陽子の数と中性子の数を書いてくれればいいじゃん!」って思うかも。なぜわざわざ質量数で表現するかは「質量数はその原子の相対質量に近い値になって便利だから」くらいに思っておくのがいいと思います(*補足)。
原子は陽子・中性子・電子で構成されますが、それぞれの質量比はおおよそ1:1:約1/1840です。たとえるなら陽子と中性子は同じ重さのボーリング玉、電子はピンポン球くらいの差があります。つまり原子の質量はほぼ陽子の数と中性子の数の足し算で決まるので、これらの和が質量数と呼ばれ、しかも相対質量に近い値になるわけですね。
ということで原子を記述するときは原子番号と質量数を用います。
同位体
原子番号が同じで質量数が違う原子を「同位体」と言います。

先ほどの説明を踏まえれば同位体は、陽子の数が同じで中性子の数が違うとも言えますね。詳しくは同位体の説明をご覧ください。
補足
この用語を含むファイル
関連動画
関連用語





