同位体
概要
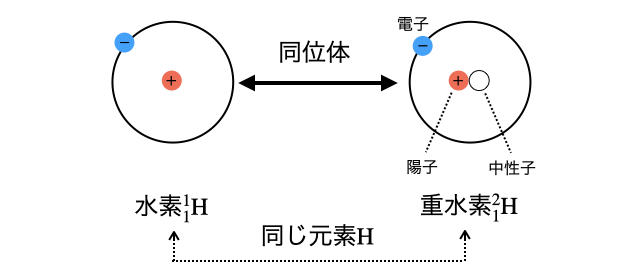
「同位体」とは、同じ元素なのに中性子数が違うやつらのこと。原子の化学的性質は陽子数(=原子番号)で決まるため、陽子数によって元素の種類が決まります。だから同じ元素なら陽子数は同じですが、同じ元素でも中性子数が異なる原子がありそれを同位体と呼びます。
また同位体のうち、放射能という物理的性質を持つ同位体を特に「放射性同位体」と呼びます。
詳細
同位体の性質
原子の種類は陽子数・中性子数で決まりますが、陽子数さえ同じなら化学的性質は同じなので、陽子数が同じ原子をまとめて1つの元素と考えます。逆に、同じ元素だけど中性子数が違う別の原子たちを同位体と言います。
たとえば水素の有名な同位体には、中性子数がそれぞれ0・1・2である水素
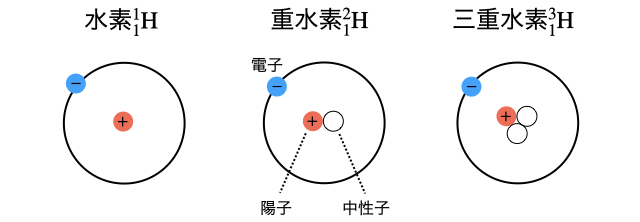
同位体は同じ元素だから化学的性質は同じです。だからたとえば水素と重水素は共に酸素と結合して水分子を作るし、ほぼ同じ化学反応を起こします。
同位体の存在比
自然界では同位体の存在比が場所によらずほぼ一定です。たとえば水素の同位体は、東京で測っても、ミシガン州で測っても、ドバイで測っても一定で、水素
同位体の存在比によって化学的性質に違いは出ませんが、物体の質量には違いが出ます。たとえば単純な話、陽子1粒の水素と陽子と中性子合わせて2粒の重水素では、質量がざっくり2倍違いますからね。
これらを考慮して物質の質量を見積もるためのものに「原子量」があります。詳しくは原子量のページをご覧ください。
補足
この用語を含むファイル
関連動画
関連用語





