水和
概要
「水和」とは、イオンや極性分子を水が取り囲むこと。水
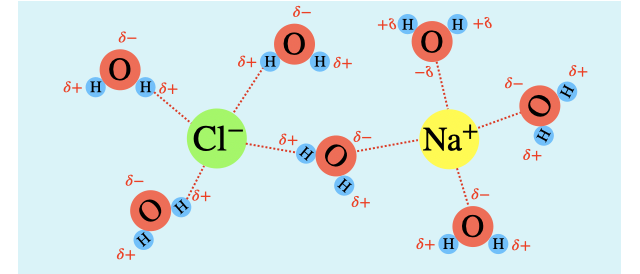
水和が起こるため極性分子は極性溶媒(水)に溶けやすいです。
詳細
水和の仕組み
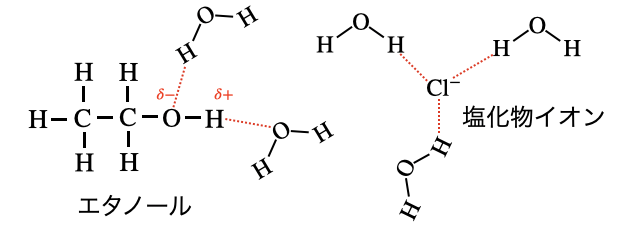
分子内の原子で電気陰性度の差があることで、電荷の偏りが生じるのが「極性」です。この偏りによって、粒子同士がクーロン力で引き合って起こるのが水和です。
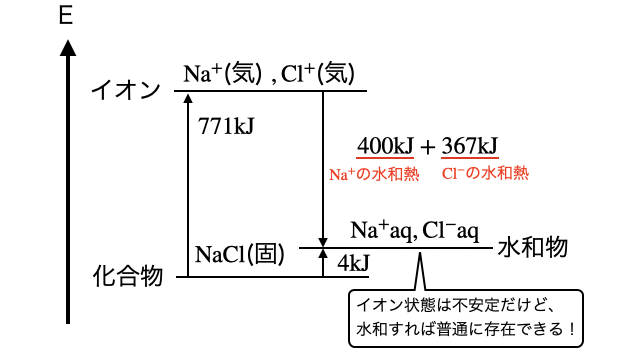
一般に水和が起こるとエネルギー的に安定になります。たとえばイオンが気体で飛び回る状態は不安定なので、イオン結晶は普通固体で存在して融点・沸点が高いですが、水中なら水和が起こって安定化することができます(*注1)。エネルギーの関係は以下の通り。
また、特定の金属イオンでは水和する水が配位結合を作ってしまう場合があります。以下のように「錯イオン」を作っているわけです(*注2)。
ただし、水和水は省略して書くルールなので、普段は単に
水和物
固体の中に水が混ざったものが水和物です。結晶を作るパズルの1ピースとして水が混ざっているイメージです。水和物を水に溶かすと、水和物に含まれていた水も溶媒になることに注意が必要です。
例:
補足
- (*注1)電離した陽イオンと陰イオンなど電荷が偏った状態は、お互い引き合う力が生じるなかわざわざバラバラになっているので不安定です。しかし、それぞれのイオンと水が引き合うことでイオン同士が引き合う必要がなくなる、と言うイメージです。
- (*注2)遷移金属イオンは(d軌道の影響などもあり)水と錯イオンを作って存在しがちです。ただたとえばナトリウムイオン
などは、きっちり決まった数が配位結合しているわけではなく、いくつかの水が入れ替わり立ち代わり水和しているイメージなので、錯イオンのような書き方はしません。
この用語を含むファイル
関連動画
関連用語





